2018年11月29日/
生物谷BIOON/---近期,
干细胞研究取得重大的进展。基于此,小编梳理了一下生物谷最新报道的
干细胞方面的新闻,供大家阅读。
1.Nature:中科院潘巍峻课题组揭示一类巨噬细胞引导造血干细胞归巢机制
doi:10.1038/s41586-018-0709-7
在造血干细胞由位于发育中的脊椎动物背主动脉(dorsal aorta)内部的内皮细胞产生后,归巢允许这些新生的造血干细胞锚定在它们的壁龛中以便发生进一步的增殖和分化。这种独特的壁龛微环境(niche microenvironment)由多种血管和诸如基质细胞之类的其他壁龛组分组成,并且调节着这个归巢过程。然而,这种壁龛微环境的详细结构和调节造血
干细胞归巢的机制仍然是不清楚的。
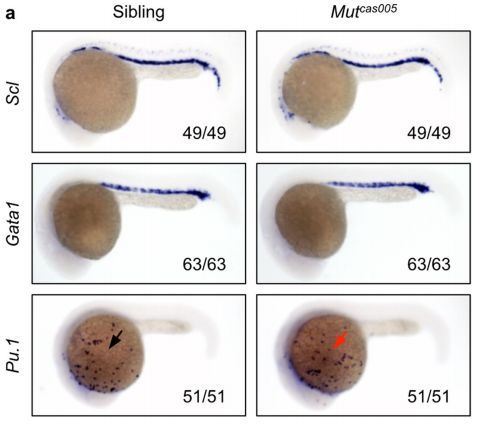
图片来自Nature, doi:10.1038/s41586-018-0709-7。
在一项新的研究中,中国科学院上海营养与健康研究院研究员潘巍峻(Weijun Pan)及其团队利用先进的实时成像和一种细胞标记系统,对斑马鱼尾部造血组织(相当于哺乳动物的胚胎肝脏)中的造血干细胞归巢进行高分辨率分析,并揭示出血管结构在调节造血
干细胞归巢到壁龛微环境中的作用。相关研究结果于2018年11月19日在线发表在Nature期刊上,论文标题为“VCAM-1+ macrophages guide the homing of HSPCs to a vascular niche”。
潘巍峻团队鉴定出一种称为VCAM-1+巨噬细胞的壁龛细胞群体在静脉丛(venous plexus)的内表面上巡逻,以一种依赖于ITGA4的方式与造血干细胞相互作用,并指导造血干细胞归巢到壁龛微环境中。这些称为先导细胞(usher cell)的细胞与尾静脉毛细血管和静脉丛一起确定了造血干细胞在壁龛微环境中的归巢热点区域。更重要的是,这些先导细胞在归巢热点区域附近巡逻,一旦发现造血干细胞来临时,就将它们引导到特定的血管结构中,从而实现造血
干细胞归巢到壁龛微环境中。
2.Nat Med和Cancer Cell两项研究揭示抑制氨基酸代谢可选择性杀死白血病干细胞
doi:10.1016/j.ccell.2018.10.005; doi:10.1038/s41591-018-0233-1
人体的大多数细胞降解葡萄糖来释放能量。有时,它们降解脂肪,而且在紧要关头时,它们甚至能够代谢蛋白。癌细胞有点不同。首先,大多数癌细胞仍然依赖于葡萄糖,但从“细胞呼吸(cellular respiration)”(需要氧气)切换为“糖酵解(glycolysis)”(当有或没有氧气时都会发生)。
在一项新的研究中,来自美国科罗拉多大学癌症中心的研究人员发现
癌症干细胞(cancer stem cell)采取第三种方法:它们坚持细胞呼吸,但从代谢葡萄糖切换为代谢蛋白,或者更准确地说,代谢氨基酸,即蛋白的构成单元(building block)。这一代谢差异是一个致命弱点,可让人们靶向癌症
干细胞同时又不伤害健康细胞。经证实这种方法在针对急性骨髓性白血病(acute myeloid leukemia, AML)的
临床试验中是有效的,而且有望治疗包括
乳腺癌、胰腺癌和
肝癌在内的其他癌症。相关研究结果发表在2018年11月12日的Cancer Cell期刊上,论文标题为“Inhibition of Amino Acid Metabolism Selectively Targets Human Leukemia Stem Cells”。论文通讯作者为科罗拉多大学癌症中心研究员Craig Jordan博士。
在AML中,人们能够利用化疗和放疗等疗法杀死大多数癌细胞,但是一小群癌症干细胞能够抵抗这些疗法,从中存活下来,从而在随后导致癌症复发。因此,人们有必要开发出一种方法来特异性地靶向这些癌症干细胞。在20多年的靶向癌症干细胞的研究中,Jordan及其团队不仅更多地了解这些癌症
干细胞,而且可能导致人们开发出可能改变AML和其他癌症标准治疗的方法。
此外,在Jordan团队开展的一项临床研究中,通过利用白血病干细胞(一种癌症
干细胞)的这种致命弱点,让不适合接受骨髓移植治疗的AML患者接受药物维奈托克(venetoclax)和阿扎胞苷(azacitidine)联合治疗,其中维奈托克是一种BCL-2抑制剂,阻断细胞摄取氨基酸的能力;阿扎胞苷是胞苷的核苷类似物,通过捕获DNA甲基转移酶,特异性抑制DNA甲基化。
临床试验结果表明这种联合治疗导致病情深度地和持续地缓解,优于现有的常规疗法。相关研究结果于2018年11月12日在线发表在Nature Medicine期刊上,论文标题为“Venetoclax with azacitidine disrupts energy metabolism and targets leukemia stem cells in patients with acute myeloid leukemia”。
3.Nature:重大进展!新方法改善干细胞疗法安全性
doi:10.1038/s41586-018-0733-7
将一种细胞疗法从实验室转移到临床需要解决两个重要的问题:它是否是有效的?它是安全的吗?细胞疗法的安全性涉及阻止或降低治疗中使用的细胞产生
肿瘤或不想要的组织或者触发可能危及患者健康的免疫反应的风险。
在一项新的研究中,来自加拿大多伦多大学、卢内菲尔德-塔嫩鲍姆研究所(Lunenfeld-Tanenbaum Research Institute)和英国爱丁堡大学的研究人员通过对干细胞进行编程使得当它们发生有害于患者的突变时就会死亡,从而改善了
干细胞疗法的安全性。开发出“安全细胞(safe cell)”是实现细胞疗法广泛应用的关键一步。相关研究结果于2018年11月14日在线发表在Nature期刊上,论文标题为“Linking a cell-division gene and a suicide gene to define and improve cell therapy safety”。论文通讯作者为多伦多大学妇产科教授和卢内菲尔德-塔嫩鲍姆研究所高级研究员Andras Nagy。
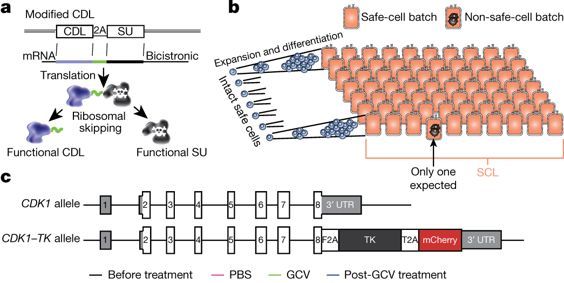
图片来自Nature, doi:10.1038/s41586-018-0733-7。
Nagy团队找到了一种方法来预测产生具有潜在危险的治疗性细胞的几率,并通过基因编辑来降低这些几率。经过基因编辑的细胞具有一个拼接到DNA中的自杀基因(HSV-TK),这个自杀基因直接连接到细胞分裂和存活所必需的一个基因(CDK1)上。如果检测到有害突变,那么使用一种小分子药物就能够阻止这些细胞发生分裂和造成伤害。它们也是隐形的,也就无需进行免疫抑制。
4.Nature:重磅!日本科学家在全球首次利用ips细胞治疗帕金森病患者
doi:10.1038/d41586-018-07407-9
将来自皮肤等身体组织的细胞进行重编程可让它们返回到一种多能的胚胎样状态,因而能够分化为其他的细胞类型。所产生的重编程细胞称为诱导性多能
干细胞(induced pluripotent stem cell, iPS细胞, iPSC)。日本神经外科医生首次将iPS细胞植入到帕金森病患者的大脑中。这只是利用
ips细胞开展
临床试验所要治疗的第二种疾病。
日本京都大学的科学家们利用一种技术将
ips细胞转化为产生神经递质多巴胺的神经元的前体细胞,即多巴胺前体细胞(dopamine precursor cell)。在帕金森病患者中,产生多巴胺的神经元短缺会导致颤抖和行走困难。
2018年10月,京都大学医院神经外科医生Takayuki Kikuchi将240万个多巴胺前体细胞植入到一名50多岁的患者的大脑中。在3小时的治疗过程中,Kikuchi及其团队让这些多巴胺前体细胞聚集到12个称为多巴胺活性中心(dopamine activity centre)的位点中。Takahashi 说,“这名患者表现良好,到目前为止没有出现重大
不良反应。”该团队将观察他六个月,如果没有出现并发症,将在他的大脑中植入另外240万个多巴胺前体细胞。
该团队计划在2020年底之前再治疗6名帕金森病患者,以便测试这种技术的安全性和有效性。
5.Cell:辅助性T细胞竟调节肠道干细胞的自我更新和分化
doi:10.1016/j.cell.2018.10.008
在一项新的研究中,来自美国布罗德研究所等研究机构的研究人员宣布他们检测到一部分肠道干细胞与生活在肠道中的辅助性T细胞(Th细胞)之间存在一种新的交谈形式。他们发现这些肠道干细胞产生MHC II,即一种允许免疫细胞与其他细胞之间交谈的表面蛋白复合物 ,所产生的MHC II会激活Th细胞。最后,他们发现这些肠道
干细胞也对附近的Th细胞产生的细胞因子作出反应。相关研究结果于2018年11月1日在线发表在Cell期刊上,论文标题为“T Helper Cell Cytokines Modulate Intestinal Stem Cell Renewal and Differentiation”。
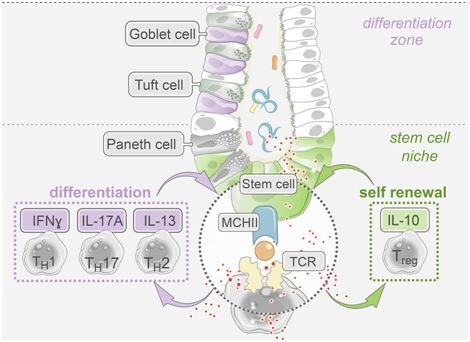
图片来自Cell, doi:10.1016/j.cell.2018.10.008。
然而,肠道干细胞如何作出反应取决于它们接收到的细胞因子信号类型。与炎症相关的细胞因子促进肠道干细胞开始分化---产生在肠道内壁中发现的不同细胞类型,这可能有助于肠道组织对损伤或感染作出反应。相比之下,肠道干细胞对起调节作用的细胞因子作出反应 ,在感染清除后通过自我更新协助降低免疫反应。这可能有助于肠道在修复后补充和维持它的肠道
干细胞库。
6.Nat Commun:一种可生物降解的微型支架有望增强干细胞疗法的作用效果
doi:10.1038/s41467-018-05599-2
近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自美国罗格斯大学等机构的科学家们通过研究开发了一种小型的可生物降解的特殊支架,其或能有效移植
干细胞并运输药物,来帮助治疗多种人类疾病,比如阿尔兹海默病、帕金森疾病、大脑退化、脊髓损伤和创伤性脑损伤等。
干细胞移植被认为有望治疗中枢神经系统疾病,然而这一技术常常受到了很多因素的限制,比如较低的细胞存活率、细胞的不完全分化以及神经连接生长受限等。这项研究中,研究人员就设计了一种新型的生物支架,其能模拟天然组织,并在检测管和小鼠机体中得到了良好的研究结果;这种
纳米尺寸的支架有望帮助促进高端的干细胞移植以及中枢神经组织的修复等,同时应用干细胞疗法也能促进
干细胞转化称为神经元细胞,并恢复患者大脑的神经回路。
7.Nature:打破传统认知!科学家首次在机体中发现特殊类型的骨骼干细胞!
doi:10.1038/s41586-018-0662-5
骨骼干细胞非常有价值,因为其能愈合很多类型的骨骼损伤,但研究人员却很多发现骨骼干细胞,因为他们并不知道骨骼干细胞的样子或者其存在的未知;近日,一项刊登在国际杂志Nature上的研究报告中,来自密歇根大学的科学家们通过研究在骨骺生长板(epiphyseal growth plate)的(resting zone)鉴别出了一类骨骼
干细胞,骨骺生长板是一类特殊的软骨组织,其是骨骼生长的重要驱动子。
研究者Noriaki Ono表示,在静止区域发现骨骼干细胞非常有意义,因为研究人员普遍认为干细胞常常处于静息状态,直到其被需要时才会激活。为了寻找这种特殊类型的
干细胞,研究者利用荧光蛋白来标记小鼠机体中的特殊细胞群体,随后随着时间延续来追踪这些细胞的命运变化,以这种方式,研究人员就能够研究这些细胞在天然状态下整个生命周期中的行为变化(并不仅仅是在培养皿中)。
研究者发现的这些特殊细胞能够满足骨骼干细胞的标准,因为其具有一些重要特性,即能够转变成为制造软骨和骨骼的细胞,还能够转化成为特殊细胞来支持血细胞的产生。研究者认为这种细胞可能只是其中一种骨骼干细胞;理解这些
干细胞在生长板中发挥的重要功能或许能够帮助研究人员阐明为何某些患者会患上特殊类型的骨骼畸形或其它骨骼疾病等。
8.Science:利用单细胞分析揭示蝾螈再生肢体机制
doi:10.1126/science.aaq0681
美西螈的肢体由许多不同的细胞类型组成,这些细胞类型源自神经细胞谱系、肌源性细胞谱系、表皮细胞谱系和结缔组织(connective tissue, CT)细胞谱系。肢体截肢后,来自截肢平面附近的细胞聚集在一个称为芽基(blastema)的独特组织中,芽基起着作为再生新肢体的祖细胞来源的作用。
在一项新的研究中,德国研究人员采用一种诱导型Cre-loxP荧光系统建立
遗传标记的转基因美西螈品系用于分离成体肢体组织中的CT细胞和芽基中的CT细胞后代。他们利用scRNA-seq沿着芽基形成和再生胳膊长出的密集时间过程以及胚胎肢体的发育阶段对CT细胞进行分子分析。这种分子分析表明CT细胞表达一进入诱导再生时就失去的成体表型。这种源自CT细胞的异质细胞群体会聚到一种均匀而又短暂的芽基祖细胞状态,这种状态在后面的阶段能够重现胚胎肢体出芽样程序。相关研究结果发表在2018年10月26日的Science期刊上,论文标题为“Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration”。
值得注意的是,这些研究人员并没有在成熟的胳膊中发现CT
干细胞或芽基样前体细胞存在的证据。他们发现CT细胞亚型对再生胳膊中的近端隔室和远端隔室作出空间限制的贡献。具体而言,一种特定的CT细胞亚型---骨骼外周细胞(periskeletal cell)---在截肢部位延伸切断的骨骼,然而成纤维细胞性的CT细胞从头再生远端的骨骼节段。通过使用高通量单细胞转录组学分析和一种基于美西螈的脑彩虹克隆谱系追踪技术,这些研究人员能够在再生的最后阶段追踪CT细胞谱系的再分化轨迹。这些发现确立了多能骨骼祖细胞(multipotent skeletal progenitor cell)的形成,而这些多能骨骼祖细胞导致肌腱、韧带、骨骼、骨骼外周和成纤维细胞产生。
9.Nature:重大发现!当再生大量骨骼时,骨骼肌干细胞返回到一种更加原始的细胞类型
doi:10.1038/s41586-018-0650-9
在一项新的研究中,来自美国斯坦福大学的研究人员一种称为ATAC-seq的技术来鉴定小鼠骨骼肌干细胞在对机械牵拉力作出反应时启动的基因开关。他们发现这些干细胞开始表达通常在颅神经嵴细胞中发现的基因,其中颅神经嵴细胞是怀孕5到6周后出现的细胞,它们能够产生头部和面部中的骨骼、软骨和结缔组织。与此同时,这些干细胞抑制参与正常骨折修复所需的基因的表达。这意味着当需要再生大量的骨骼时,小鼠骨骼
干细胞退回到一种在发育上更加灵活的状态。相关研究结果于2018年10月24日在线发表在Nature期刊上,论文标题为“Mechanoresponsive stem cells acquire neural crest fate in jaw regeneration”。
这些发现首次表明在环境信号作出反应时,哺乳动物骨骼肌干细胞在一种称为去分化的过程中能够沿着发育时间轴向后移动,从而变得更加原始。特别值得一提的是,这些
干细胞似乎非常类似于一种通常在人类怀孕后几周内出现的细胞类型,即颅神经嵴细胞。
在缺乏将骨骼分开的机械力的情况下,小鼠骨骼干细胞在不表达颅神经嵴基因的情况下修复骨折。进一步的研究发现,粘着斑激酶(focal adhesion kinase)分子通路是在这些干细胞能够检测和响应机械力中起着至关重要的作用。抑制这一通路破坏了这些
干细胞在牵张成骨过程中再生新骨的能力。
10.Science:修复面部缺陷有戏!发现神经嵴细胞从头部后面迁移到前面
doi:10.1126/science.aau3301; doi:10.1126/science.aav3376
诸如腭裂和面部麻痹之类的面部缺陷占全球所有出生缺陷(每年320万例)的三分之一,并且是婴儿死亡的主要原因。在一项新的研究中,来自英国和西班牙的研究人员发现形成面部特征的胚胎
干细胞,称为神经嵴细胞(neural crest cell),使用一种意想不到的机制,从头部后面移动到前面,从而定植在面部中。这一发现可能有助于了解面部缺陷是如何形成的,从而让人们更接近一步修复胚胎中的颅面畸形(craniofacial malformation)。这种新的机制可能在其他的涉及细胞运动的过程(比如转移过程中的癌症浸润或伤口愈合)中起着重要的作用,这可能为开发出新的疗法铺平了道路。相关研究结果发表在2018年10月19日的Science期刊上,论文标题为“Supracellular contraction at the rear of neural crest cell groups drives collective chemotaxis”。论文通信作者为英国伦敦大学学院细胞与发育生物学教授Roberto Mayor。论文第一作者为伦敦大学学院的Adam Shellard和 András Szabó。

这些研究人员研究了青蛙和鱼类的胚胎,这是因为它们的神经嵴细胞的行为方式与人类相似,而且它们的运动经常用于研究癌症扩散。此外,能够在不造成伤害的情形下研究青蛙和鱼类的胚胎发育。通过利用光
遗传学技术,他们使用光来控制神经嵴细胞簇的行为。在鉴定出包围着神经嵴细胞簇的可拉伸的肌动球蛋白环(actomyosin ring)以及这种肌动球蛋白环发生收缩从而导致神经嵴细胞簇移动之后,他们发现位于胚胎后面的神经嵴细胞接受激光束照射时,它们在肌动球蛋白环的作用下发生收缩,从而向面部移动。
 图片来自Nature, doi:10.1038/s41586-018-0709-7。
图片来自Nature, doi:10.1038/s41586-018-0709-7。  图片来自Nature, doi:10.1038/s41586-018-0733-7。
图片来自Nature, doi:10.1038/s41586-018-0733-7。  图片来自Cell, doi:10.1016/j.cell.2018.10.008。
图片来自Cell, doi:10.1016/j.cell.2018.10.008。 